- Wat is thermisch evenwicht?
- Wat is thermisch evenwicht?
- Thermische evenwichtsformule
- Nulwet van de thermodynamica
- Voorbeelden van thermisch evenwicht
We leggen uit wat thermisch evenwicht is, waaruit het bestaat en wat de formule is. Ook de nulwet van de thermodynamica en voorbeelden.

Wat is thermisch evenwicht?
Infysiek, Thermisch evenwicht wordt de toestand genoemd waarin twee lichamen die in contact zijn, of gescheiden zijn door een geleidend oppervlak, hun aanvankelijk ongelijksoortige temperaturen gelijkmaken als gevolg van de overdracht van warmte van de ene naar de andere.
Als we twee objecten in contact hebben, de ene heter dan de andere, zullen na verloop van tijd beide dezelfde temperatuur bereiken en als er geen overdracht van warmte ten opzichte van andere objecten, zullen ze voortaan een thermisch evenwicht handhaven, dat wil zeggen, a temperatuur- constante.
Wat is thermisch evenwicht?

Dit fenomeen kan microscopisch worden verklaard, in de wetenschap dat de temperatuur van objecten direct gerelateerd is aan de Kinetische energie gemiddelde van jedeeltjes, zijnatomen, moleculen, of die moeten worden overwogen. Dit gemiddelde is wat in de natuurkunde gewoonlijk "interne energie" wordt genoemd, dus hoe hoger de kinetische energie, hoe hoger de interne energie en hoe hoger de temperatuur van het systeem.
Twee lichamen die met elkaar in contact staan wisselen energie uit naarmate de tijd verstrijkt. En zo wordt het thermische evenwichtspunt bereikt wanneer de kinetische energie van beide lichamen gelijk is, zodat beide lichamen gaan werken als een enkel thermodynamisch systeem, begiftigd met dezelfde hoeveelheid interne energie en dus temperatuur.
Thermische evenwichtsformule
De uitdrukking van thermisch evenwicht omvat de berekening van het temperatuurverschil tussen de twee lichamen, dus de hoeveelheid warmte (Q) die ze uitwisselen, moet worden bepaald.
Dit wordt bepaald met de formule Q = m. Ce. t, waar m zal zijnmassa- van het lichaam, Ce suspecifieke hitte uitgedrukt in cal / gr ° C, en Δt is de temperatuurvariatie, dat wil zeggen: Δt = tf - ti, eindtijd minus begintijd.
Zodra de warmte Q voor elk lichaam is berekend, kunnen we ze vergelijken, wetende dat het thermisch evenwicht optreedt in de gelijkheid van de temperaturen tussen lichaam 1 en lichaam 2. Om thermisch evenwicht te bereiken, de warmte die het koudste lichaam krijgt. dat het heetste lichaam verliest, dus Q1 = Q2, dat wil zeggen, gewonnen warmte = verloren warmte.
Nulwet van de thermodynamica
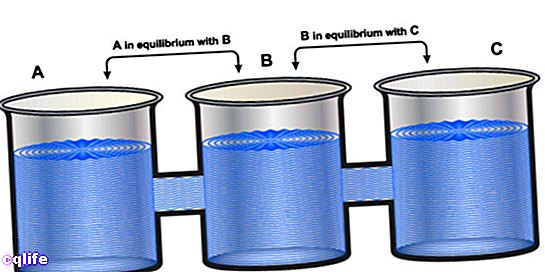
Dit principe wordt uitgedrukt in de zogenaamde nulwet van de thermodynamica, die in 1931 door R.H. Fowler als volgt werd uitgedrukt: "Als twee systemen A en B worden gevonden, elk afzonderlijk, in thermisch evenwicht met een derde systeem, die we C zullen noemen, dan zijn A en B ook in thermisch evenwicht met elkaar ”.
Dat wil zeggen: als A = C en B = C, dan is A = B.
Dankzij dit principe, dat is gebaseerd op de wiskundige formulering van de thermodynamica, is bekend wat Maxwell op deze manier in woorden uitdrukte: "Alle warmte is van hetzelfde type."
Voorbeelden van thermisch evenwicht
Hier zijn enkele eenvoudige voorbeelden van thermisch evenwicht:
- Wanneer we een warme kamer binnenkomen, nemen we de warmte van delucht onmiddellijk maar met een marge vanweer, zal ons lichaam warmte uitwisselen met de lucht en daarmee in thermisch evenwicht komen, waardoor we het temperatuurverschil niet meer waarnemen.
- Als we een glazen container met koud water in een grotere met kokend water plaatsen, zal de warmtestroom tussen de twee het hete water afkoelen en het koude water verwarmen, totdat een gemiddeld thermisch evenwicht wordt bereikt.
- De producten die we in onze keukenvriezer hebben staan in thermisch evenwicht ten opzichte van de bevroren lucht ertussen, zodat ze allemaal dezelfde temperatuur delen.
