- Wat is een atoom?
- Hoe is een atoom opgebouwd?
- Hoe combineren atomen?
- Delen van een atoom
- Geschiedenis van het atoom
- Molecuul
We leggen uit wat een atoom is en hoe elk van zijn onderdelen is opgebouwd. Ook de geschiedenis, studies erover en wat een molecuul is.

Wat is een atoom?
De kleinste eenheid die de . vormt materie.
Het woord atoom komt uit het Oudgrieks (atoom, "Zonder verdeling") en werd bedacht door de eerste filosofen die theoretiseerden over de samenstelling van dingen, dat wil zeggen, de elementaire deeltjes van de universum. Sindsdien, met de opkomst van de atoommodellen, de manier om ze voor te stellen is enorm gevarieerd, aangezien een atoommodel de vorige door de eeuwen heen opvolgde, totdat we het model bereikten dat we vandaag gebruiken.
Atomen hebben de eigenschappen van chemish element die samenstellen en op hun beurt worden de elementen georganiseerd en geclassificeerd volgens hun atoomnummers, elektronische configuratie en chemische eigenschappen in Periodiek systeem van de elementen.
Hetzelfde scheikundige element kan zijn samengesteld uit verschillende atomen van dezelfde klasse, dat wil zeggen met hetzelfde atoomnummer (aantal protonen die elk atoom in het element heeft), hoewel hun atomaire massa verschillend is.
Er zijn bijvoorbeeld verschillende atomen van hetzelfde element die verschillen in hun aantal neutronen, en ze worden isotopen genoemd, een representatief geval zijn de isotopen van het element koolstof (12C, 13C, 14C). Dus elk atoom behoort tot hetzelfde chemische element of niet, afhankelijk van het aantal protonen, dus atomen met hetzelfde aantal protonen behoren tot hetzelfde chemische element.
Hoe is een atoom opgebouwd?
Atomen bestaan uit een kern en een of meer elektronen (die een negatieve lading hebben) eromheen. De kern bestaat uit deeltjes die protonen en neutronen worden genoemd. Protonen zijn positief geladen en neutronen zijn neutraal. De verzameling protonen en neutronen worden nucleonen genoemd.
Protonen en elektronen worden tot elkaar aangetrokken door de elektromagnetische kracht (de interactie van geladen deeltjes met elektrische en magnetische velden), terwijl protonen en neutronen tot elkaar worden aangetrokken door de kernkracht (een kracht die alleen wordt ervaren door de deeltjes waaruit de atoomkern).
Hoe combineren atomen?
Atomen kunnen met elkaar combineren om te vormen chemische verbindingen, wat er gebeurt als ze hun elektronen op de een of andere manier delen. Chemische bindingen kunnen zijn: covalent, ionisch ja metalen, die covalente moleculaire verbindingen, ionische netwerken of metaalverbindingen voortbrengt (hoewel het belangrijk is om te verduidelijken dat geen enkele chemische binding absoluut covalent of ionisch is). Op deze manier kunnen atomen zich combineren om te vormen moleculen eenvoudig zoals de Water, evenals om te vormen macromoleculen complexe zoals eiwit, DNA ja RNA.
Hoewel atomen zich van elkaar onderscheiden door de configuratie van hun deeltjes, is het ook zo dat alle atomen van hetzelfde element exact identiek zijn: de waterstofatomen in de zon Ze zijn dezelfde als die waaruit ons lichaam bestaat, en de koolstofatomen in het lichaam van een hond zijn identiek aan die waaruit een diamant bestaat. Het verschil zit in de manier waarop de atomen samen de verschillende chemische verbindingen vormen die de organen en orgaansystemen in de levende wezens, de materialen gegenereerd in de industrieen alle materie waaruit het universum bestaat.
Delen van een atoom
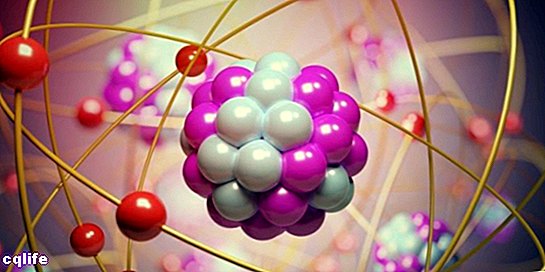
Atomen bestaan uit twee essentiële onderdelen:
- De kern. Ongeveer 99,94% van de massa van een atoom is geconcentreerd in de kern, waar de protonen en neutronen (die samen "nucleonen" worden genoemd) zijn, verbonden door sterke kernkrachten, die voorkomen dat de protonen die ze elkaar afstoten, dezelfde elektrische aanval.
- De atomaire orbitalen. Een orbitaal beschrijft een gebied in de ruimte rond de atoomkern waarin de waarschijnlijkheid om een elektron te vinden is erg hoog. Deze regio's hebben verschillende vormen die worden verkregen als resultaat van het oplossen van de stationaire Schrödinger-vergelijking. Erwin Schrödinger was een Oostenrijkse wetenschapper die deze vergelijking in 1925 ontwikkelde om de evolutie van een subatomair deeltje, zoals elektronen, te berekenen. Zo vormen de elektronen een soort "wolk" rond de kern, die wordt weergegeven door de vorm van de atomaire orbitalen. Aan de andere kant komt elke atomaire orbitaal overeen met een bepaalde energiewaarde voor elektronen, dus zijn ze georganiseerd volgens hun energiewaarden. De volgende afbeelding toont de vormen van de eerste atomaire orbitalen:

Geschiedenis van het atoom

De eerste die het idee van het bestaan van atomen formuleerde, was de Griekse filosoof Democritus (s.V-VI BC) van puur denkbeeldige speculaties (zoals wetenschap destijds werd begrepen).
Zijn studies werden overgenomen door latere filosofen zoals Leucippus en Epicurus, maar het werd verwaarloosd tijdens de middeleeuws, overschaduwd door de creationistische verklaring van de wereld, die alles aan God toeschreef.
We moesten wachten tot 1773 toen de Franse chemicus Antoine de Lavoisier zijn theorie postuleerde over het niet-scheppen of vernietigen van materie (het transformeert alleen) of Wet van behoud van massa, waardoor John Dalton in 1804 de eerste moderne atoomtheorie kon formuleren.
Opeenvolgende geleerden van de fysiek en de chemie ze werden geïnspireerd door zijn werk om betere en complexere systemen voor te stellen om de fundamentele deeltjes van materie te begrijpen. Vervolgens werden nieuwe atoommodellen voorgesteld tot aan de modellen die tegenwoordig het meest worden gebruikt.
De hedendaagse geaccepteerde structuur is die afgeleid van de experimenten van Rutherford in 1911, samen met de formuleringen van Niels Bohr, Schrödinger en Heisenberg.
Molecuul
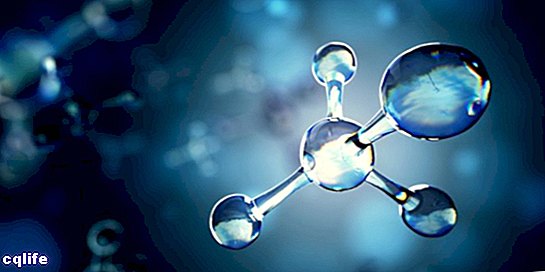
Een molecuul staat bekend als de vereniging van twee of meer atomen door chemische bindingen om een complexere en elektrisch neutrale structuur te vormen. Chemische bindingen kunnen covalent of ionisch zijn.
Moleculen kunnen bestaan uit atomen van hetzelfde chemische element, bijvoorbeeld het zuurstofmolecuul (O2), of uit atomen van verschillende chemische elementen, bijvoorbeeld het glucosemolecuul. Monoatomaire gassen, bijvoorbeeld helium (He), worden ook als moleculen beschouwd.

