- Wat zijn koolwaterstoffen?
- Kenmerken van koolwaterstoffen
- Classificatie van koolwaterstoffen
- Belang van koolwaterstoffen
- Derivaten en toepassingen van koolwaterstoffen
- Milieu-impact van koolwaterstoffen
We leggen uit wat koolwaterstoffen zijn, hun kenmerken en hoe ze worden ingedeeld. Daarnaast zijn derivaten, toepassingen en milieu-impact.

Wat zijn koolwaterstoffen?
Koolwaterstoffen zijn verschillende soorten verbindingen biologisch. Ze kunnen een grotere of kleinere complexiteit hebben, maar ze bestaan altijd uit een skelet van atomen koolstof (C) en waterstof (H), evenals andere eventuele elementen.
Elke koolwaterstof vertoont zijn structurele patronen, aangezien zijn specifieke configuratie zijn fysische en chemische eigenschappen bepaalt, evenals de naam van de substantie waar het over gaat. De Aardolie, de natuurlijk gas en steenkool zijn de belangrijkste bronnen van koolwaterstoffen.
De meeste koolwaterstoffen bevinden zich in het binnenste van de aarde, begraven onder lagen en lagen van gesteente en ik meestal. Ze zijn het product van de anaërobe ontbinding, onder zeer specifieke omstandigheden, van grote hoeveelheden organisch materiaal, die in de oudheid het lichaam van verschillende levende wezens.
Koolwaterstoffen zijn ook aanwezig in het lichaam van verschillende levende wezens, onder specifieke vormen zoals het rubber dat rubberbomen genereren, of een reeks pigmenten die carotenen worden genoemd en die sommige planten bevatten. Bovendien kunnen ze worden gesynthetiseerd in een laboratorium, rekening houdend met de grondstof adequaat.
Gezien hun enorme chemische en energiepotentieel zijn koolwaterstoffen een onmisbaar onderdeel van verschillende industrieën, waaronder, bij het verkrijgen van elektrische energie.
Kenmerken van koolwaterstoffen
Enkele kenmerken van koolwaterstoffen zijn:
- Ze bestaan voornamelijk uit koolstof en waterstof, en eventuele toevoegingen van andere elementen of andere radicale groepen. Terwijl hun koolstofatomen de structuur van de verbinding vormen, dienen die van waterstof in sommige gevallen als een brug om ze bij elkaar te houden in een configuratie (vorm, structuur, oriëntatie) bepaald.
- Ze kunnen een frame hebben van moleculen lineair of vertakt, open of gesloten. Het hangt af van de volgorde en de hoeveelheid componenten of het de ene of de andere koolwaterstof is.
- Ze zijn licht ontvlambaar en hebben een enorme energiecapaciteit, waardoor ze een ideale grondstof zijn voor industriële transformatie en voor het winnen van energie.
- Ze zijn meestal giftig en kunnen afkomstig zijn van dampen gevaarlijk voor Gezondheid.
Classificatie van koolwaterstoffen
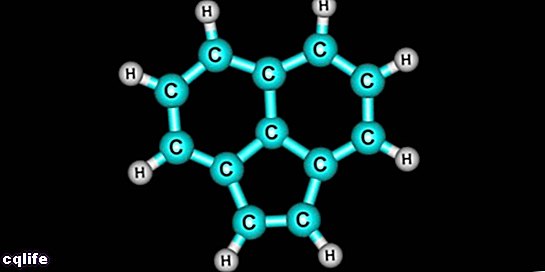
Sinds hun ontdekking in de 19e eeuw zijn koolwaterstoffen geclassificeerd volgens twee mogelijke criteria: hun type structuur en de soorten bindingen tussen hun atomen. Volgens de eerste classificatie worden twee categorieën onderscheiden:
- Acyclische of open keten koolwaterstoffen. Het zijn degenen waarvan de keten van moleculen zichzelf niet sluit. Ze kunnen op hun beurt worden onderverdeeld in lineair (lijnvormig) of vertakt (met verschillende takken). Bijvoorbeeld:
- Cyclische of gesloten koolwaterstoffen. Het zijn degenen wiens keten van moleculen zichzelf sluit. Ze kunnen op hun beurt worden onderverdeeld in monocyclisch (enkele cyclus) en polycyclisch (meerdere cycli). Bijvoorbeeld:
Als we de tweede classificatie gehoorzamen, hebben we in plaats daarvan:
- Aromatische koolwaterstoffen. Ze hebben een aromatische ring, dat wil zeggen een cyclische structuur die voldoet aan de zogenaamde Hückel-regel, die stelt dat het aantal gedelokaliseerde elektronen in een aromatische verbinding voldoet aan:
Waar:
-
- N. vertegenwoordigt een geheel getal.
- Nee. Vertegenwoordigt het aantal elektronen gedelokaliseerd in de aromatische verbinding.
Benzeen (C6H6) heeft bijvoorbeeld 6 gedelokaliseerde elektronen (pi (𝛑) elektronen genoemd) in zijn structuur, wat betekent dat N moet gelijk zijn aan 1.
Bijna alle aromatische koolwaterstoffen zijn meestal afgeleid van benzeen (hoewel niet altijd) en daarom maakt de hexagonale structuur van benzeen deel uit van veel van deze aromatische verbindingen. De naam "aromatisch" komt van het feit dat deze verbindingen aanvankelijk werden verkregen door degradatie chemische substanties fijne geur. Enkele voorbeelden van aromatische verbindingen zijn:
- Alifatische koolwaterstoffen. Ze missen een aromatische ring. De naam komt van het Grieks aleifar, dat wil zeggen, "vet", omdat ze werden verkregen door de ontleding van oliën en vetten. Ze worden geclassificeerd als verzadigd (begiftigd met enkele atoombindingen) en onverzadigd (met ten minste één meervoudige, dubbele of drievoudige binding). Enkele voorbeelden van alifatische koolwaterstoffen zijn:
Belang van koolwaterstoffen
Koolwaterstoffen zijn uiterst veelzijdige stoffen omdat ze dienen als: grondstof zeer gevarieerde producten te verkrijgen. Bovendien hebben ze een groot energiepotentieel, dat wil zeggen, hun verbranding is gemakkelijk en intens, zodat ze energetisch een gevarieerde set van industrieën, variërend van materialen, oplosmiddelen, de fossiele brandstoffen, tot de opwekking van elektrische energie.
Daar komt nog bij dat hun vorming miljoenen jaren van langzame chemische processen onder de grond heeft gekost, zodat ze een belangrijke hulpbron vormen, maar niet-hernieuwbaar, die op een dag voor altijd (of in ieder geval voor een lange tijd) uitgeput zal zijn. Het gebruik ervan moet plaatsvinden onder omstandigheden van extreme verantwoordelijkheid.
Derivaten en toepassingen van koolwaterstoffen

Koolwaterstoffen hebben een enorm aantal toepassingen voor de mens, waaronder opvallen:
- Stroomopwekking. Dankzij zijn enorme capaciteit om verbranding, koolwaterstoffen worden gebruikt als krachtbron Genereren elektriciteit. Dit wordt uitgevoerd in bepaalde soorten energiecentrales en levert energie aan zowel huizen als andere industrieën en maakt het mogelijk onze manier van leven te ondersteunen.
- De opwekking van brandstoffen. Dankzij hun energiecapaciteit kunnen ze verschillende soorten brandstoffen (benzine, diesel, natuurlijk gas vloeibaar gemaakt), voor het aandrijven van verschillende soorten voertuigen, of voor het aandrijven van verschillende huishoudelijke apparaten zoals ruimteverwarmingstoestellen, fornuizen en verwarmingstoestellen die werken met gassen zoals butaan of propaan.
- Het verkrijgen van kunststoffen. Verschillende soorten plastic en veelzijdige materialen kunnen in laboratoria worden verkregen door de behandeling van koolwaterstoffen. Deze materialen zijn zo goedkoop, efficiënt en eenvoudig te vervaardigen dat er een enorme industrie omheen bestaat.
- De vervaardiging van oplosmiddelen en andere producten. Veel koolwaterstoffen zijn essentiële componenten van oplosmiddelen en oplosmiddelen, schoonmaakproducten, meststoffen of bitumen.
Milieu-impact van koolwaterstoffen
Het gebruik van koolwaterstoffen heeft zijn kosten, en de eerste: invloed hij pakt het omgeving. Over het algemeen gaat het om giftige stoffen, die grote ecologische schade kunnen aanrichten in het geval dat ze worden gedumpt in de natuur, zoals bij olielozingen of olielekken. Het herstellen van deze milieuschade is vaak kostbaar en tijdrovend.
Bovendien stoten, afhankelijk van de koolwaterstof, het vrijkomen of de verbranding ervan gassen uit van broeikaseffect naar atmosfeer, dat wil zeggen, koolstofrijke gassen zoals methaan (CH4) of kooldioxide (CO2).
Deze gassen kunnen de ozonlaag de planeet, en blokkeren ook de ontsnapping van energie door de atmosfeer, wat een dramatische bijdrage levert aan de opwarming van de aarde en naar klimaatverandering. De verbranding van fossiele brandstoffen is namelijk een van de belangrijkste factoren in dit mondiale probleem.
